59
Q1848019
Teclas de Atalhos
Compartilhar
Ano:
2014
A entalpia de combustão é uma diferença de entalpia (ΔH) observada na reação química entre um mol de uma substância (o combustível) e o oxigênio (o comburente), formando gás carbônico e vapor de água.
O gráfico a seguir apresenta a entalpia de combustão, em certa temperatura, para o etano, o propano, o butano, o pentano e o hexano.
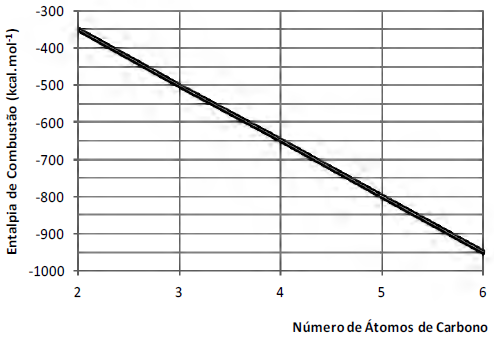
De acordo com o gráfico pode-se estimar que:
A
1000 kcal são liberados na combustão de 1 mol de hexano.
B
650 kcal são necessárias para a combustão de 1 mol de butano.
C
700 kcal são necessárias para a combustão de 2 mols de etano.
D
500 kcal são liberados na combustão de 3 mols de propano.
E
1600 kcal são liberados na combustão de 2 mols de pentano.