A história da Tabela Periódica pode ser comparada a uma larga avenida de duas mãos. Num primeiro sentido, foram sendo lentamente descobertos diversos elementos químicos, pelas razões e métodos os mais distintos. Depois de se conhecerem algumas dezenas de elementos, passou se a buscar correlações entre eles, para se entender suas peculiaridades, afinidades e reatividades. […] Dessa maneira se passou do conjunto de 63 elementos, conhecidos ao tempo de Mendeleev, aos 118 que constituem a Tabela Periódica moderna.
LIMA, G. M.; BARBOSA, L. C. A.; FILGUEIRAS, C. A. L. Origens e consequências da tabela periódica, a mais concisa enciclopédia criada pelo ser humano Quim. Nova, v. 42, n. 10, p. 1125 1145, 2019.
Dentre as propriedades contempladas na tabela periódica, está o raio atômico, que pode ser estimado a partir das distâncias entre os núcleos de dois átomos ligados entre si (Figura 1).
Figura 1: Esquema para a estimativa do raio atômico do átomo de cloro a partir da molécula de Cl2
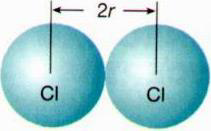
O tamanho de um determinado átomo está relacionado com o número de partículas que ele contém e também com a distribuição dos elétrons pelos seus níveis de energia. De maneira geral, a tabela periódica indica que o raio atômico de um átomo aumenta ao longo de um mesmo grupo e diminui ao longo de um mesmo período, ou seja, aumenta de cima para baixo e da direita para a esquerda (Figura 2).
Figura 2: Tendência nos valores de raios atômicos de elementos da tabela periódica
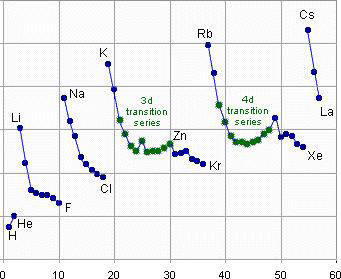
Levando se em consideração o aumento do número atômico ao longo do período, o efeito responsável por essa tendência atípica é:
a repulsão das cargas nucleares sobre os elétrons, que é menor que o efeito de repulsão entre os elétrons.
a atração das cargas nucleares sobre os elétrons, que é maior que o efeito de repulsão entre os elétrons.
o aumento do número de prótons e, consequentemente, redução da carga nuclear.
a repulsão entre os núcleos, que aumenta com o aumento do raio atômico.
o aumento do número de elétrons na última camada.