Para proteger um metal I da corrosão, pode-se utilizar outro metal II que apresenta uma tendência maior de perder elétrons (menor potencial de redução). Esse metal II se oxida e evita a corrosão do metal I, sendo, por isso, chamado de metal de sacrifício ou ânodo de sacrifício.
(Modificado de USBERCO, João; SALVADOR, Edgard. Química. 12. ed. São Paulo: Editora Saraiva, 2009, Vol.2, p. 295.)
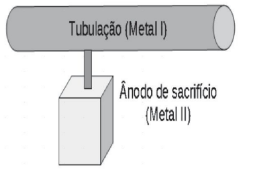

Baseado na proteção contra a corrosão da tubulação e considerando o esquema e os processos eletroquímicos envolvidos, são feitas as seguintes afirmativas:
| - O metal níquel pode ser utilizado como ânodo de sacrifício (metal II) caso a tubulação (metal I) seja de cobre.
II - O ânodo de sacrifício (metal II) sofre uma reação de redução, aumentando sua massa ao longo do tempo.
III - O metal cobre pode ser utilizado como ânodo de sacrifício (metal II) caso a tubulação (metal I) seja de ferro.
IV - O metal usado no eletrodo de sacrifício (metal II) será o agente oxidante na reação eletroquímica.
V - Caso a tubulação (metal 1) seja de ouro, o ânodo de sacrifício (metal II) pode ser constituído por qualquer um dos outros metais apresentados na lista acima.
Das afirmativas feitas, estão corretas apenas
I, II, IV e V.
I e V.
I, III e IV.
II e III.
III, IV e V.